fluor predstavlja kemični element z atomsko številko 9 in spada med halogene. Je močno koroziven plin, ki povzroči hude poškodbe sluznice. Fluor se uporablja za medicinsko uporabo v obliki soli, fluorida, za krepitev zob.
Kaj je fluor?
Fluor je visoko kavstičen in reaktiven plin, ni spojina, temveč kemični element, ki spada med halogene. Z atomsko številko 9 je najlažji halogen. V naravi se fluor pojavlja predvsem v obliki njegovih soli, fluoridov.
Plinski fluor ni zelo stabilen in reagira s skoraj vsemi spojinami in elementi takoj po njegovi proizvodnji. Samo z žlahtnimi plini helij in neon ni reakcije. To izredno močno reaktivnost je mogoče razložiti z zelo močno afiniteto do elektronov. Vedno odvzame elektrone od svojih reakcijskih partnerjev in je zato najmočnejše oksidacijsko sredstvo. Ime fluor izhaja iz latinskega "fluores" (reka). Kot kalcijev fluorid (fluorspar) služi kot tok za rude.
Ko v rude dodamo fluorspar, zniža njihovo tališče, tako da hitreje postanejo tekoče. S konceptualnega vidika v medicini obstaja izraz fluorine genitalis za brezkrvno odvajanje izločkov iz ženskih spolovil. Vendar pa genitalnega fluora ne smemo zamenjati z elementom fluora.
Funkcija, učinek in naloge
Fluor se imenuje bistveni element v sledovih. Vendar je pomen fluora sporen. Znano je, da imajo fluoridi zaščitne lastnosti pred zobmi. Fluorid lahko okrepi zobe in hkrati zavira nekatere encime kariesnih bakterij, ki povzročajo razgradnjo ogljikovih hidratov.
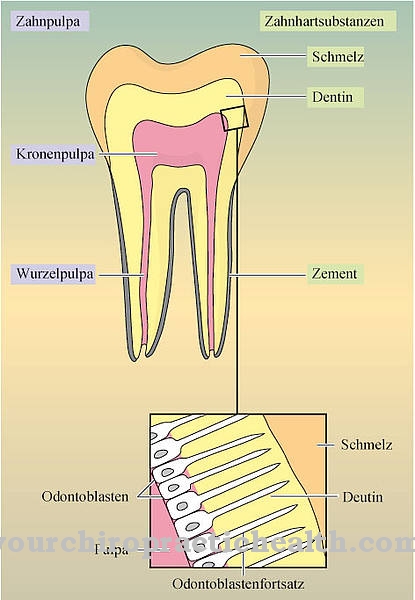
Fluoridi delujejo neposredno na zob. Peroralno zaužitje fluorida ne vpliva na zobe. Zobje so sestavljeni večinoma iz mineralnega hidroksiapatita. Hidroksiapatit lahko napadejo kisline, ki nastanejo pri razpadu ostankov hrane. Slaba zobna higiena zato pogosto povzroči luknje v zobeh, ki jih še vedno zasedajo kariesne bakterije. Na primer, če zobna pasta vsebuje fluorid, pride do izmenjave hidroksilnih ionov s fluoridnimi ioni. Tako nastane fluorapatit, ki se izkaže za trši material in manj ranljiv za kisline. Celo hidroksiapatit, raztopljen s kislinami, lahko ponovno oborimo kot fluoroapatit v prisotnosti fluoridov.
Začetno uničenje je torej mogoče obrniti. Toda fluoridi imajo tudi pozitivne lastnosti za gradnjo kosti. Tukaj vnos poteka oralno. Otrokom in dojenčkom dajemo fluor in vitamin D za preprečevanje rahitisa. Vendar s fluoridom ne smemo predozirati, da se ne bi mogla razviti fluoroza z okorelostjo in zgostitvijo sklepov. Fluorjeve spojine so odobrene tudi kot zdravila za osteoporozo. Ustrezne tablete vsebujejo natrijev fluorid ali dinatrijev fluorofosfat.
Izobraževanje, pojav, lastnosti in optimalne vrednosti
Fluor je v obliki fluoridov v črnem in zelenem čaju, špargelih in tudi v ribah. Veliko soli vsebuje fluorid. Čiste fluorove soli zaradi majhne topnosti spojin, ki vsebujejo fluoride v vodi, ni. V zemeljski skorji sta najpogostejša fluor (kalcijev fluorid) in fluorapatit.
Fluor je v glavnem izdelan iz kalcijevega fluorida. Obstajajo celo organizmi, ki lahko tvorijo organofluorove spojine. Južnoafriški gifblaar ali rastline iz rodu Dichapetalum lahko sintetizirajo fluoroocetno kislino proti plenilcem. Človeški organizem ima dnevno potrebo 0,25-0,35 mg.
Bolezni in motnje
Vendar so zastrupitve s fluorom in zdravstvene težave pogostejše. Kot smo že omenili, je čisti fluor zelo strupen koroziven plin. To je tudi tisto, kar otežuje izdelavo fluora.
Ker reagira s skoraj vsemi materiali, ga je mogoče skladiščiti in prevažati zelo slabo. Ko se zastrupimo s fluorom, pride do kemičnih opeklin in opeklin v pljučih, na koži in v očeh. Glede na odmerek se ustrezni organi v kratkem času raztopijo, kar ima za posledico smrt. Smrtonosni odmerek je zelo nizek in znaša 185 ppm. Zastrupitev s fluorom s čistim fluorom se bo redko pojavila, ker plin ni stabilen. Vendar je zastrupitev z vodikovim fluoridom podobno nevarna. Vodikov fluorid tvori vodikove vezi z beljakovinami v telesu, pri čemer se uniči terciarna struktura proteinov. Poteka denaturacija telesnih beljakovin.
Fluoridi lahko tvorijo kompleksne spojine z aluminijevimi ioni, ki imajo podoben učinek kot fosfati. V telesu te spojine posegajo v reakcije fosforilacije. Med drugim to vodi v deregulacijo beljakovin G, zaradi česar mnogi encimi inhibirajo. Samo zaradi tega telo povečanega odmerka fluorida ne prenaša. Jemanje preveč fluoridnih tablet lahko povzroči tudi slabost, bruhanje in drisko. Fluor reagira s želodčno kislino, pri čemer nastane majhna količina fluorovodikove kisline. Ta napade sluznico. Kronično, blago preveliko odmerjanje fluorida lahko povzroči fluorozo.
Fluoroza je kronična zastrupitev s fluorom s spremembami strukture zobne sklenine, kašljem, sputumom in pomanjkanjem sape. Preveč hidroksiapatita se v zobeh spremeni v fluoroapatit. Zobje postanejo bolj krhki. Kosti se spreminjajo tudi zaradi prekomernega tvorjenja fluorapatita. Kosti se počasi otrdijo in predelajo. Poleg tega encim enolaza zavira.

.jpg)








.jpg)