Lizil oksidaza je encim vezivnega tkiva, ki ima katalitične naloge in spodbuja navzkrižno povezovanje kolagena in elastina. Encim ima stabilizirajoč vpliv na vezivno tkivo, saj izvaja oksidativno razkrojevanje in tako ustvarja osnovne pogoje za navzkrižno vezanje. Pri Cutis laxi se aktivnost lizilooksidaze zmanjša.
Kaj je lizil oksidaza?
V človeškem telesu obstajajo različni encimi, vsi pa imajo katalitično aktivnost. Encimi omogočajo reakcije v človeškem telesu ali jih pospešijo. Lizil oksidaza je encim, ki ga najdemo v človeškem vezivnem tkivu. Imenujejo ga tudi beljakovina lizin 6 oksidaza in se nahaja predvsem v zunajceličnem prostoru vezivnega tkiva.
Katalitična aktivnost encima se v tem primeru nanaša na povezanost kolagena in elastina. Lizil oksidaza mehansko stabilizira oba proteina in tako omogoča reaktivno povezavo. Lizil oksidaza ni samo v človeškem telesu. Tudi drugi vretenčarji so opremljeni z encimom. Šteje se, da je liziksoksidaza stabilizator vezivnega tkiva. Pomanjkanje encima vodi do klinične slike cutis laxa, hude in dedne oslabelosti vezivnega tkiva.
Funkcija, učinek in naloge
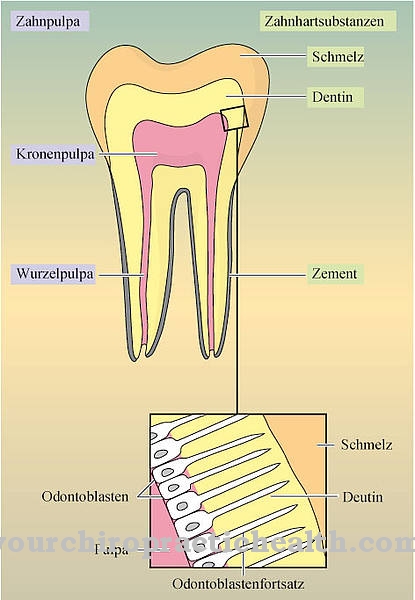
Lizil oksidaza prevzame pomembne naloge v zunajceličnem prostoru v navzkrižni povezavi med posameznimi molekuli kolagena. V človeškem telesu ima kolagen glavno vlogo znotraj beljakovin, saj predstavlja približno 30 odstotkov celotne beljakovinske mase.
Kolagen je najpogostejši protein. Je strukturni in gradbeni protein, ki sestavlja številne sestavine telesa, kot so vezivno tkivo, kosti, zobje, hrustanec, kite, ligamenti in koža. Lizil oksidaza podpira vezavo kolagena na karbonilne skupine in tako prispeva k stabilnosti omenjenih telesnih komponent. Katalitično deluje na proizvodnjo karbonilnih skupin, ki tvorijo kovalentne navzkrižne vezi na kolagenih v aldolni kondenzaciji. Katalitična naloga lizilooksidaze je torej priprava na tvorbo fibril. Encim ustvarja vse kemične pogoje, ki so potrebni za tvorbo.
Vlaknine veljajo za vlakna vlaken. Ustrezajo tankim in vlaknastim delom telesa in jih najdemo v rastlinskih celičnih stenah, v človeških mišicah in v vezivnem tkivu. Naloga lizil oksidaze v tem smislu je v bistvu oksidativno razkrojevanje lizilnih ostankov. V kemiji je deaminacija kemična cepitev amino skupin kot amonijevih ionov ali amoniaka. Oksidativna deaminacija razdeli aminokisline aminokisline L-glutamat iz vodika in jih oksidira v imino skupine s prenosom vodika v NAD + ali NADP +.
Sledi hidrolizno cepitev imino skupin kot amonijevih ionov, kar je povezano s tvorbo α-keto kisline. Deaminacija ustreza prvemu koraku biokemične razgradnje aminokislin, ki pri sesalcih poteka predvsem v jetrih. Amonijev ion, ki nastane med raztapljanjem, se pretvori v sečnino. Deaminacijski procesi lizilooksidaze povzročijo aldehidne skupine, ki skupaj s posameznimi aminokislinami drugih lizilnih ostankov povzročijo tako imenovane Schiffove baze in tako lahko tvorijo stabilizirajoče navzkrižne vezi v kolagenu.
Izobraževanje, pojav, lastnosti in optimalne vrednosti
Lizil oksidazo v DNK kodira gen LOX, ki se pri ljudeh nahaja na kromosomu 5 v loku gena q23.3 do q31.2. Genski produkt ni končna oblika encima. Izdelek ni končana lizil oksidaza, ampak predhodna oblika, ki ima po prevodu molsko maso 47 kDa.
V nadaljnjem poteku pride do glikozilacije. Med tem postopkom se molarna masa kasnejšega encima poveča na 50 kDa, predhodna oblika lizil oksidaze pa se izloči v zunajcelični prostor. Po izločanju pre-pro-lizil-oksidaza obdelamo naprej. Snov se cepi v zunajceličnem prostoru. Protein 1. je odgovoren za cepitev na dva fragmenta, na ta način se na eni strani proizvede 32 kDa lizil oksidaza. Po drugi strani nastane preostala snov, ki v tem primeru ustreza polipeptidu.
Bolezni in motnje
Genetske okvare lizil oksidaze lahko povzročijo klinično sliko cutix laxe. Ta bolezen se imenuje tudi dermatokalaza in se nanaša na skupino pogosto povezanih starostnih šibkosti vezivnega tkiva, ki jih v večini primerov opazimo z družinskim kopičenjem.
Skupna značilnost vseh pojavov dermatohalaze je povešena in neelastična koža, ki se na različnih delih telesa pogosto obeša v velikih gubah. Večina prizadetih je zaradi sprememb videti starejša, kot so. Bolezni med drugim povzročajo genetske mutacije. V tem kontekstu govorimo o sindromu cutis laxa. Bolezen lahko obstaja v avtosomno recesivnih, avtosomno dominantnih in x-kromosomskih oblikah. V mnogih primerih je sindrom cutis laxa povezan z drugimi anomalijami in, če so na primer vpleteni organi, je lahko usoden.
ARCL1 ustreza cutis laxa avtosomno recesivnega tipa 1 in velja za najtežjo obliko, ki lahko v določenih okoliščinah povzroči življenjsko nevarne zaplete. Oblika ARCL1A je povezana z mutacijami v genu FBLN5 na mestu 14q32.12. Tip ARCL1B je povezan z mutacijami v genu EFEMP2 na lokusu 11q13.1, varianta ARCL1C pa ustreza cutis laxa s spremljajočimi anomalijami v pljučih, prebavilih in sečilih, ki so posledica mutacij v genu LTBP4 na mestu 19q13.2.
Mutacije v omenjenih genih vodijo do podpovprečne aktivnosti liksiloksidaze. Nezadostne navzkrižne povezave nastanejo zaradi zmanjšane aktivnosti encima. Bolnikovo vezno tkivo ni dovolj stabilizirano.

.jpg)




.jpg)








.jpg)