Beljakovine Tropomiozin se pojavlja predvsem v progastih mišicah in sodeluje pri krčenju mišic. Genske mutacije lahko vplivajo na strukturo proizvedenih molekul tropomiozina in s tem povzročijo številne bolezni - vključno z različnimi oblikami kardiomiopatije, pa tudi arthrogryposis multiplex congenita in nemalinsko miopatijo.
Kaj je tropomiozin?
Tropomiozin je protein, ki ga najdemo v človeškem telesu predvsem v skeletnih mišicah. Biokemik Kenneth Bailey je beljakovine prvič opisal leta 1946. Eno mišico sestavljajo številni svežnja mišičnih vlaken, ki so sestavljena iz mišičnih vlaken.
Vsako vlakno ni sestavljeno iz ene same jasno definirane mišične celice, temveč iz tkiva z veliko celičnimi jedri. Znotraj teh enot miofibrili predstavljajo lepša vlakna; njihovi prečni odseki se imenujejo sarcomeres. Sarkomere sestavljata dve vrsti pramenov, ki se izmenično potisneta drug v drugega, kot zobnik ali zadrga. Nekateri od teh pramenov so miozin, drugi so kompleks aktina in tropomiozina. V tej kompleksni molekuli aktina tvorita debelo verigo, okoli katere sta navita dva pramena tropomiozina.
Anatomija in struktura
Tropomiozin je sestavljen iz dveh delov: α in β. Oba gradnika imata skupaj 568 aminokislin, od tega je 284 α-tropomiozin in 284 β-tropomiozin. Te aminokisline se vrstijo v vrsti in tvorijo dolge verige, preden se končno združijo in tvorijo makromoleku v obliki palice.
Zaporedje aminokislin in struktura proteina sta genetsko določena; pri ljudeh so za to odgovorni naslednji geni: TPM1 na 15. kromosomu, TPM2 na 9. kromosomu, TPM3 na prvem kromosomu in TMP4 na 19. kromosomu. Pramen tropomiozin (z obema podenotama) se vije okoli debelejših aktinskih filamentov v progastih skeletnih mišicah. Nanj je pritrjen tudi troponin, še en protein.
Funkcija in naloge
Za strjevanje skeletnih mišic je potreben tropomiozin. Ko živčni impulz doseže mišico, se električni dražljaj sprva širi skozi sarkolemmo in T-tubule in končno vodi do sproščanja kalcijevih ionov v sarkoplazmatskem retikulu.
Ioni se začasno vežejo na troponin, ki se nahaja na pramenu tropomiozina. Posledično kalcijevi ioni spreminjajo fizikalne lastnosti molekule. Troponin se rahlo premakne na površini in se tako odmakne od mest, na katera se lahko veže tudi miozin. Miozin tvori komplementarna vlakna v kompleksu aktin / tropomiozin. Na koncu miozinske nitke sta dve tako imenovani glavi. Glave miozina se lahko vežejo na področja aktinove nitke, ki jih troponin ne zaseda več.
Ko se pritrdijo na vlakno, se miozinske glave prepognejo in se potisnejo med aktinsko / tropomiozinsko nitko, kar skrajša sarkomere. Hkrati se ta postopek ne dogaja samo v enem sarcomereju, ampak v mnogih. Številni pogodbeni sarcomeri povzročajo krčenje mišičnih vlaken in s tem mišice kot celote. Živčni signal pogosto stimulira več sto mišičnih vlaken. Plastificirajoči učinek adenozin trifosfata (ATP) omogoča, da se glava miozina odcepi od aktina.
Krčenje gladkih mišic je nekoliko drugačno. Gladke mišice obkrožajo organe pri ljudeh ali jih najdemo v stenah krvnih žil. Lahko sklene več kot progaste mišice. Medtem ko imajo skeletne mišice progaste strukture, gladke mišice tvorijo ravno površino, sestavljeno iz posameznih celic. Poleg aktina in tropomiozina imajo gladke mišice kaldesmon in kalmodulin, še dva proteina, katerih medsebojno delovanje vpliva na napetost v mišicah. Tropomiozin deluje predvsem na kalmodulin.
Poleg tega ima tropomiozin tudi vlogo pri drugih bioloških procesih. Zdi se, da na primer vpliva na vezavo aktina v citoskeletu in vpliva na delitev celic.
Bolezni
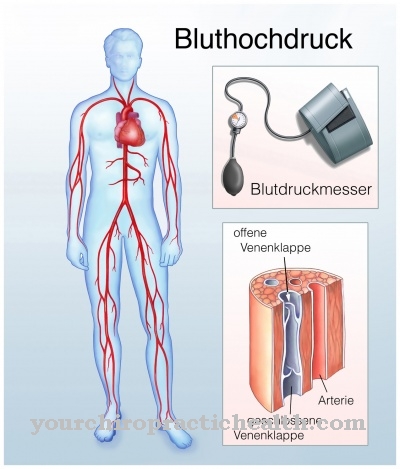
Ena bolezen, ki je lahko povezana s tropomiozinom, je hipertrofična kardiomiopatija. To je srčna bolezen, pri kateri se sarcomeri (odseki mišičnih vlaken) zgostijo, kar vpliva tudi na debelino mišičnih vlaken kot celote.
Posledično se lahko razvijejo simptomi, kot so občutek pritiska v prsih, omotica, zasoplost, sinkopa in napadi angine. V tem primeru se vrnejo k funkcionalnim težavam srčne mišice. Najpogostejši vzrok (40–60%) hipertrofične kardiomiopatije je v genih: spremembe (mutacije) vodijo do napak v genetskem zapisu in s tem do napačne sinteze beljakovin. To lahko vpliva tudi na različne beljakovine, ki sestavljajo mišična vlakna.
Pri restriktivni kardiomiopatiji srčna mišica postane utrjena. Vzrok je presežek vezivnega tkiva. Restriktivna kardiomiopatija vodi do srčnega popuščanja, za katero so značilne motnje dihanja, edemi, suh kašelj, utrujenost, izčrpanost, omotica, sinkopa, palpitacije in različne prebavne motnje. Prizadeti so manj verjetno zmedeni, trpijo zaradi težav s spominom ali oslabljene kognitivne zmogljivosti. Razširjena kardiomiopatija je lahko tudi posledica napake v genih tropomiozin.
Ko se ta srčna bolezen manifestira, je pogosto povezana z globalnim srčnim popuščanjem in / ali progresivnim popuščanjem levega srca. Poleg tega se lahko pojavijo motnje dihanja, embolije in srčne aritmije. Dve drugi bolezni, ki sta lahko povezani s tropomiozinom in delno temeljita na mutacijah, sta nemalinska miopatija, pri kateri se lahko mišice oslabijo na več načinov, in artrogryposis multiplex congenita, pri kateri se sklepi otrdijo. Vendar pa imajo lahko vse te bolezni tudi druge vzroke, mutacije v genih tropomiozina so le ena od možnosti.