Hidroksilizin je neklasična proteinogena aminokislina. Vgrajen je v ustrezen protein kot lizin in hidroliziran v hidroksilizin znotraj polipeptida s pomočjo encima. Je ena glavnih sestavin kolagenskih beljakovin v vezivnem tkivu.
Kaj je hidroksilizin?
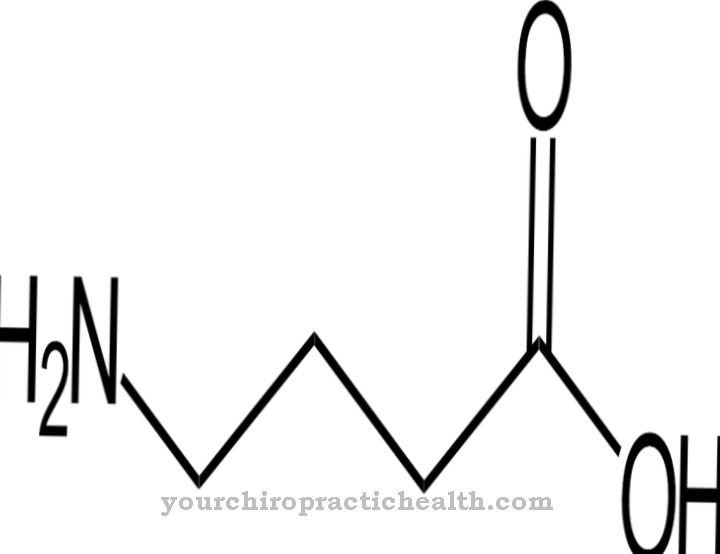
Hidroksilizin je proteinogena aminokislina, ki se najprej vključi v protein kot lizin. Zato gre za nekanonsko proteinogeno aminokislino. Izraz "kanonik" pomeni klasično.
Torej za to aminokislino ni kodona. Hidroksilizin se nahaja predvsem v kolagenu vezivnega tkiva in v glikoproteinih. Tam se lizin preko encimskih procesov pretvori v hidroksilizin. Samo del lizina se pretvori v hidroksilizin. Lastnosti posameznih kolagena so odvisne od količine hidroliziranih ostankov lizina in prolina.
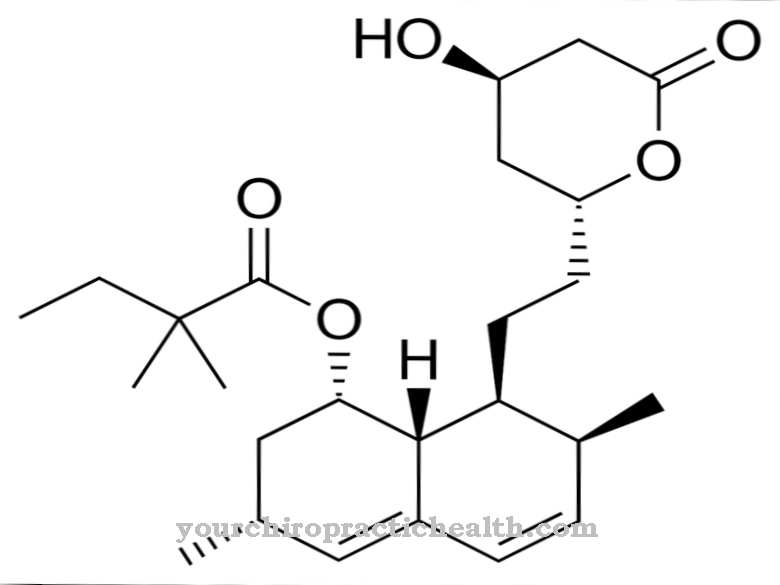
Hidroksilizin lahko izoliramo v prosti obliki kot hidroklorid. Hidroklorid hidroksilizina je bež prah s tališčem od 225 do 230 stopinj. To je bazična aminokislina, zaradi katere beljakovine, ki vsebujejo hidroksilizin, reagirajo tudi bazično. Hidroksilizin je odkril ameriški biokemik in soustanovitelj "Klinične kemije" Donald Van Slyke (1883-1971).
Funkcija, učinek in naloge
Hidroksilizin ima velik pomen za strukturo vezivnega tkiva. Glikoproteini vsebujejo tudi hidroksilizin, da tvorijo glikozidne spojine proteina s sladkornimi ostanki na hidroksilnem ostanku.
Znotraj kolagena je odgovoren za navzkrižno povezavo posameznih beljakovinskih molekul. Skupaj s hidroksilprolinom, hidroliziranim oblikom prolina, pomaga tudi pri izgradnji kolagenskih terciarnih in kvaternarnih struktur. Hidroksilacija lizina katalizira encim lizil hidroksilaza s sodelovanjem kofaktorskih železovih ionov in askorbinske kisline (vitamin C). Vzorec porazdelitve hidroksiliranih ostankov lizina v kolagenu ni posebej tog in prožen. Vedno se ponavljajo vzorci.
Vendar pa so znotraj beljakovin tudi celotna območja, ki ne vsebujejo hidroksiliranih ostankov lizina. Medtem ko je hidroksiprolin odgovoren za spiralno strukturo kolagena prek vezave treh beljakovinskih verig, se preko hidroksilnih skupin hidroksilizina oblikujejo navzkrižne povezave med različnimi proteinskimi molekulami. Poleg tega te molekularne skupine služijo tudi kot vezivno mesto za glikozidno vez s sladkorjem. Na splošno to zagotavlja trdnost vezivnega tkiva.
Če v hidroksilizinu primanjkuje beljakovin, tega ne moremo odpraviti z dodatnim vnosom aminokisline. Za prosti hidroksilizin ni kodona, zato ga ni mogoče vključiti v ustrezen protein. Vrednost prehranskih dopolnil z dodanim hidroksilizinom je zato zelo vprašljiva. Zato mora pomanjkanje nastati zaradi nezadostne hidroksilacije lizina.
Izobraževanje, pojav, lastnosti in optimalne vrednosti
Hidroksilizin najdemo le v človeškem in živalskem kolagenu. Obstaja tudi nekaj glikoproteinov, ki vsebujejo tudi hidroksilizin. To vključuje adiponektin. Adiponektin je hormon, ki se proizvaja v maščobnem tkivu in odločilno vpliva na učinkovitost inzulina. Hidroksilizin so odkrili tudi pri nekaterih bakterijah, kot je Staphylococcus aureus.
Porazdelitev hidroksiliranega lizina v kolagenu ni enakomerna. Obstajajo lokacije, kjer ga skoraj vedno najdemo. Na drugih območjih hidroksilizina skoraj nikoli ne najdemo. Ta neenakomerna porazdelitev določa strukturo kolagena. Znotraj strukture kolagena s trojno vijačnico je hidroksilizin vedno na položaju Y v ponavljajočem se zaporedju Gly-X-Y. V kratkih predelih z ne-spiralno strukturo se hidroksilizin pojavlja tudi v drugih krajih.
Bolezni in motnje
Vezno tkivo je popolnoma odvisno od prisotnosti hidroksilizina. Kolagen je lahko stabilen in trden le, če delujejo navzkrižne vezi med beljakovinskimi molekulami. Pomanjkanje hidroksilizina povzroča šibkost vezivnega tkiva.
Če bi bil prisoten le v izjemno majhnih količinah ali ga sploh ni, ustrezen organizem ne bi bil sposoben preživeti. Vezno tkivo ni moglo več opravljati svoje naloge kot omejevalno in podporno tkivo za organe. Pravzaprav obstajajo bolezni, ki jih je mogoče spremljati v pomanjkanju hidroksilizina. Ker je ta aminokislina prvotno vključena kot lizin med sintezo beljakovin, to ne more biti primarna pomanjkljivost. Hidroksilizin nastane iz lizina znotraj kolagenskih beljakovin s pomočjo lizil hidroksilaze. Pomanjkanje hidroksilizina je lahko le posledica okvare tega encima ali njegove nezadostne funkcije.
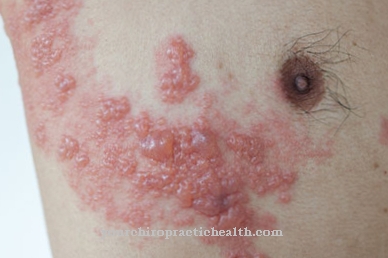
Obstaja skupina heterogenih prirojenih slabosti vezivnega tkiva, ki je znana kot Ehlers-Danlos sindrom. Za to klinično sliko so lahko odgovorne številne mutacije. Med drugim je lahko tudi lizil hidroksilaza pokvarjena, tako da hidroksilira premalo lizina. Ehlers-Danlos sindrom se manifestira s čezmerno raztezljivostjo kože in prekomerno gibljivostjo sklepov. Prizadeti so tudi notranji organi, krvne žile, kite, ligamenti in mišice. Prognoza je odvisna od resnosti okvare. Če bodo plovila vključena, je pričakovati neugoden potek. Popolna okvara encima lizil hidroksilaza ni združljiva z življenjem, zato je ne opazimo.
Toda tudi pri nepoškodovanem encimu je zaradi njegove nizke aktivnosti lahko prisotno šibko vezivno tkivo. Lizil hidroksilaza potrebuje kofaktorje ione železa in askorbinsko kislino (vitamin C). Če na primer primanjkuje vitamina C, pride do tega, kar imenujemo skorbut. Skrv je pridobljena bolezen vezivnega tkiva, ki jo povzroča pomanjkanje hidroksilnih skupin na prolinskih in lizinskih ostankih kolagena. Vzrok je nizka aktivnost prolin hidroksilaze in lizin hidroksilaze zaradi pomanjkanja askorbinske kisline.